摘要:研究發(fā)現(xiàn)KDM4C通過調(diào)控GRHL2的K453甲基化,激活CTSL介導(dǎo)的組蛋白H3剪切,進(jìn)而抑制GCLC表達(dá)導(dǎo)致氧化應(yīng)激。
乳腺癌作為高度異質(zhì)性疾病,基底型亞型因其三陰性特征(ER-/PR-/HER2-)和缺乏有效靶點(diǎn),成為臨床治療難點(diǎn)。盡管表觀遺傳調(diào)控在腫瘤中的作用日益受到關(guān)注,但組蛋白去甲基化酶KDM4家族在乳腺癌中的具體機(jī)制仍不明確。尤其令人困惑的是,KDM4C在基底型乳腺癌中頻繁擴(kuò)增,但其促癌機(jī)制與傳統(tǒng)組蛋白去甲基化功能(H3K9me3/H3K36me3)的關(guān)聯(lián)性存在矛盾。這些科學(xué)問題促使研究人員探索KDM4C在基底型乳腺癌中非經(jīng)典作用機(jī)制。
美國(guó)Dana-Farber癌癥研究所等機(jī)構(gòu)的研究團(tuán)隊(duì)通過整合多組學(xué)分析和功能實(shí)驗(yàn),首次揭示KDM4C通過調(diào)控CTSL介導(dǎo)的組蛋白H3剪切影響腫瘤氧化還原平衡的全新機(jī)制。研究發(fā)現(xiàn)不僅解釋了KDM4C擴(kuò)增型腫瘤的獨(dú)特依賴性,還為靶向表觀遺傳-代謝交叉調(diào)控提供了理論依據(jù),相關(guān)成果發(fā)表在《Nature Genetics》期刊。
 圖1 抑制 KDM4C 可通過促進(jìn)組織蛋白酶 L 介導(dǎo)的組蛋白 H3 剪切來阻斷基底型乳腺癌的腫瘤生長(zhǎng)。
圖1 抑制 KDM4C 可通過促進(jìn)組織蛋白酶 L 介導(dǎo)的組蛋白 H3 剪切來阻斷基底型乳腺癌的腫瘤生長(zhǎng)。研究主要采用CRISPR-Cas9基因編輯構(gòu)建CTSL敲除模型,結(jié)合RNA-seq和ChIP-seq分析轉(zhuǎn)錄組和染色質(zhì)狀態(tài)變化,通過質(zhì)譜技術(shù)檢測(cè)組蛋白修飾和代謝物變化,并利用患者來源異種移植(PDX)模型驗(yàn)證治療靶點(diǎn)。此外,采用高通量藥物篩選平臺(tái)PRISM評(píng)估KDM4抑制劑QC6352的療效。
KDM4C在乳腺癌中的擴(kuò)增特征與功能
通過TCGA和METABRIC隊(duì)列分析發(fā)現(xiàn)KDM4C在基底型乳腺癌中特異性擴(kuò)增,且與不良預(yù)后相關(guān)。體外實(shí)驗(yàn)顯示,KDM4C敲除或抑制劑(ML324/QC6352)處理能顯著抑制KDM4C擴(kuò)增型細(xì)胞系的增殖,而催化活性缺失突變體(KDM4CS198M)無法挽救該表型,證實(shí)其促癌作用依賴去甲基化酶活性。值得注意的是,KDM4A/B敲除未產(chǎn)生類似效應(yīng),表明KDM4C在基底型乳腺癌中具有獨(dú)特功能。
KDM4C阻斷誘導(dǎo)的轉(zhuǎn)錄組與染色質(zhì)重塑
RNA-seq分析發(fā)現(xiàn)KDM4C抑制主要下調(diào)膽固醇穩(wěn)態(tài)和氧化磷酸化通路,同時(shí)激活TGF-β信號(hào)。ATAC-seq顯示染色質(zhì)可及性廣泛改變,但H3K9me3/H3K36me3全局水平未見顯著變化。質(zhì)譜分析意外發(fā)現(xiàn)組蛋白H3/H4 N端剪切現(xiàn)象,經(jīng)蛋白酶抑制劑篩選確定CTSL為關(guān)鍵效應(yīng)分子。免疫印跡證實(shí)KDM4C抑制導(dǎo)致H3 C端片段積累,該過程在CTSL敲除細(xì)胞中被阻斷。
CTSL的染色質(zhì)招募與激活機(jī)制
ChIP-seq揭示CTSL通過GRHL2轉(zhuǎn)錄因子被招募至染色質(zhì)。RIME和質(zhì)譜分析發(fā)現(xiàn)KDM4C抑制導(dǎo)致GRHL2 K453單甲基化,而K453R突變體無法激活CTSL。Hi-ChIP證實(shí)CTSL介導(dǎo)的組蛋白剪切改變了染色質(zhì)高級(jí)結(jié)構(gòu),這些變化與基因表達(dá)抑制顯著相關(guān)。
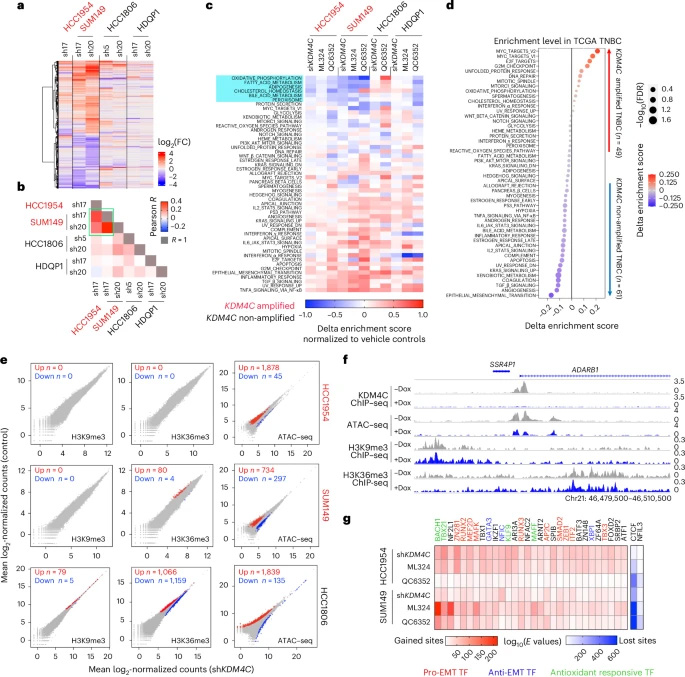 圖2 KDM4C抑制所致的轉(zhuǎn)錄組和染色質(zhì)重塑
圖2 KDM4C抑制所致的轉(zhuǎn)錄組和染色質(zhì)重塑代謝重編程與氧化應(yīng)激的調(diào)控回路
代謝組學(xué)顯示KDM4C抑制顯著降低GSH/GSSG水平,伴隨ROS升高。時(shí)間進(jìn)程實(shí)驗(yàn)表明GRHL2甲基化早于ROS升高,提示其作為初始觸發(fā)信號(hào)。機(jī)制上,CTSL剪切通過抑制GCLC啟動(dòng)子可及性,阻斷GSH合成通路,形成正反饋循環(huán)增強(qiáng)CTSL活性。
臨床轉(zhuǎn)化價(jià)值
研究者構(gòu)建的KDM4C/GSH雙靶向策略在PDX模型中顯示出與順鉑的協(xié)同效應(yīng)。臨床數(shù)據(jù)分析顯示KDM4C特征與化療耐藥相關(guān),為精準(zhǔn)治療提供了生物標(biāo)志物。
這項(xiàng)研究突破了傳統(tǒng)表觀遺傳調(diào)控框架,首次闡明KDM4C-CTSL-GCLC軸在基底型乳腺癌中的核心作用。該通路通過整合染色質(zhì)重塑(CTSL介導(dǎo)的H3剪切)、轉(zhuǎn)錄調(diào)控(GRHL2甲基化)和代謝重編程(GSH合成抑制)三重機(jī)制,為理解表觀遺傳-代謝交互提供了新范式。更重要的是,研究發(fā)現(xiàn)為KDM4C擴(kuò)增型乳腺癌的靶向治療開辟了新途徑,特別是針對(duì)難治性三陰性乳腺癌的聯(lián)合治療策略具有重要臨床轉(zhuǎn)化價(jià)值。
參考資料
[1] KDM4C inhibition blocks tumor growth in basal breast cancer by promoting cathepsin L-mediated histone H3 cleavage
 |
 |
 |
| 官網(wǎng):www.baichuan365.com |
微信服務(wù)號(hào):iseebio |
微博:seebiobiotech |
 |
 |
 |
| 商城:mall.seebio.cn |
微信訂閱號(hào):seebiotech |
泉養(yǎng)堂:www.canmedo.com |
 圖1 抑制 KDM4C 可通過促進(jìn)組織蛋白酶 L 介導(dǎo)的組蛋白 H3 剪切來阻斷基底型乳腺癌的腫瘤生長(zhǎng)。
圖1 抑制 KDM4C 可通過促進(jìn)組織蛋白酶 L 介導(dǎo)的組蛋白 H3 剪切來阻斷基底型乳腺癌的腫瘤生長(zhǎng)。