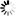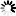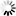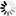新發現揭示:神經元是如何維持其通信能力的鈣離子通道的?
摘要:神經元之間傳遞信號需要通過鈣離子帶動包裹了信號分子的小囊泡移動融合到下一神經元。鈣離子通道是神經細胞信號交流的關鍵組分之一,那神經細胞是如何維持和調節這個鈣離子通道的豐度和補給的?“可塑性”發生時這些鈣離子通道會發生什么變化?
神經系統的運作是基于神經元之間通過被稱為突觸的連接進行信號交流。當鈣離子通過離子通道進入充滿了攜帶分子信息的小囊泡的“活性區”時,細胞之間得以“交談”。帶電的鈣離子使小囊泡“融合”到突觸前神經元的外膜,將用于交流的化學物質釋放到突觸后細胞中。在一項新的研究中,麻省理工學院Picower學習和記憶研究所的科學家們揭示了神經元是如何建立和維持這一重要基礎設施的。
“鈣離子通道是鈣流入的主要決定因素,然后觸發囊泡融合,所以它是突觸前側將電信號轉換為化學突觸傳輸的引擎的關鍵組成部分,”Troy Littleton說,他是這項新研究的高級作者,麻省理工學院生物、大腦和認知科學系的Menicon神經科學教授。“我們真的不清楚它們是如何在活性區積聚的。我們的研究揭示了活性區是如何積累以及調節鈣離子通道豐度的線索。”“眾所周知,突觸前鈣離子通道功能的調節具有非常重要的臨床效果,了解這些通道如何調控的基礎非常重要。”
神經科學家一直在尋找這些線索。理解這個過程可以幫助揭示神經元如何改變它們的溝通方式,這種被稱為“可塑性”的能力是學習、記憶和其他重要大腦功能的基礎。另一個原因是,像加巴丁這樣的藥物,可以治療癲癇、焦慮和神經疼痛等多種疾病,它結合了一種與鈣通道密切相關的名為alpha2delta的蛋白質。通過揭示更多關于alpha2delta的確切功能,該研究更好地解釋了這些治療的影響。
Cac的上限
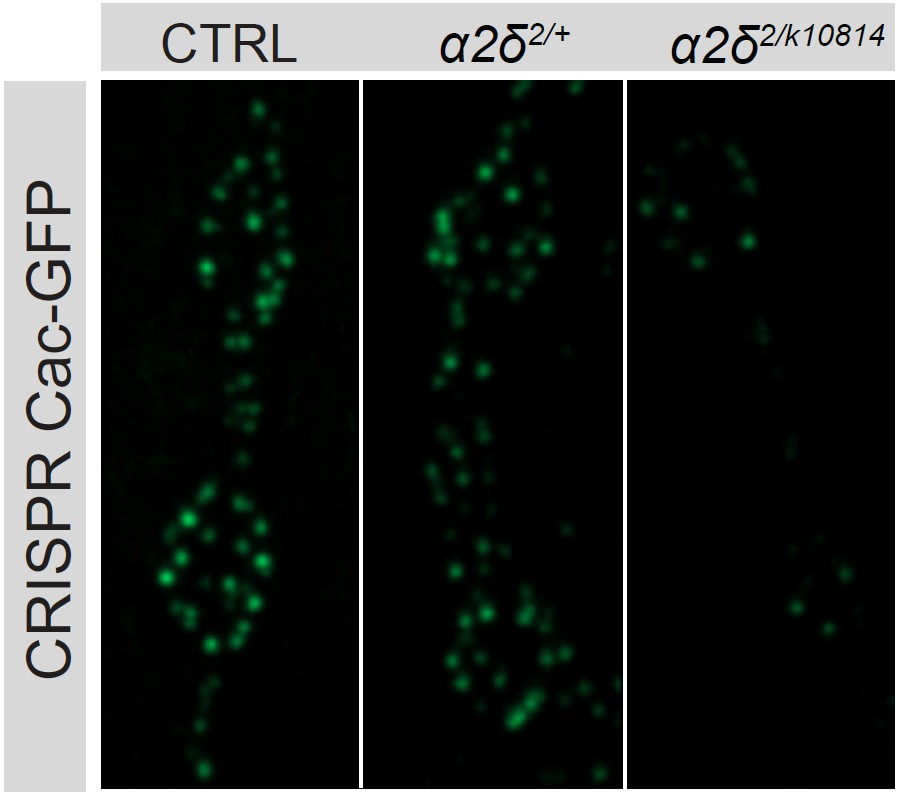
圖片:科學家通過不同的操作敲除一種名為alpha2delta的蛋白質(右兩列)越多,與未改變的對照組(左列)相比,
在蒼蠅神經元突觸活動區積累的Cac鈣通道(亮度和綠點數量)就越少。
麻省理工學院博士后Karen Cunningham是論文第一作者,她利用果蠅運動神經元的模型系統,首次展示神經元活性區的鈣離子通道是如何分布和維持的。Cunningham提出的第一個問題是在幼蟲體內的發育中鈣離子通道對活性區是否必要。但果蠅的鈣離子通道基因(Cac)是如此重要,果蠅生命不能沒有它。因此,Cunningham不能在果蠅中敲除Cac,而是使用了一種技術,只在一組神經元群體中敲除它。通過實驗表明,即使沒有Cac,活性區也能正常生長和成熟。
使用另一種人工延長果蠅幼蟲階段的技術,她還觀察到,如果給予額外的時間,活性區將繼續用一種名為BRP的蛋白質構建其結構,但Cac的積累在正常的6天后停止。Cunningham還發現,神經元中可用Cac供應的適度增加或減少并不影響每個活性區最終的Cac數量。更奇怪的是,她發現雖然Cac的數量確實與每個活性區的大小成比例,但即使她減少了活性區中的大量BRP,它只是輕微發生變化。事實上,神經元似乎對每一個活性區的Cac含量設定了一個穩定的上限。
Cunningham說:“這揭示了神經元活性區的結構蛋白有著非常不同的規則,比如隨著時間的推移繼續積累的BRP,而鈣離子通道則受到嚴格的調控,其豐度被限制。”
定期更新
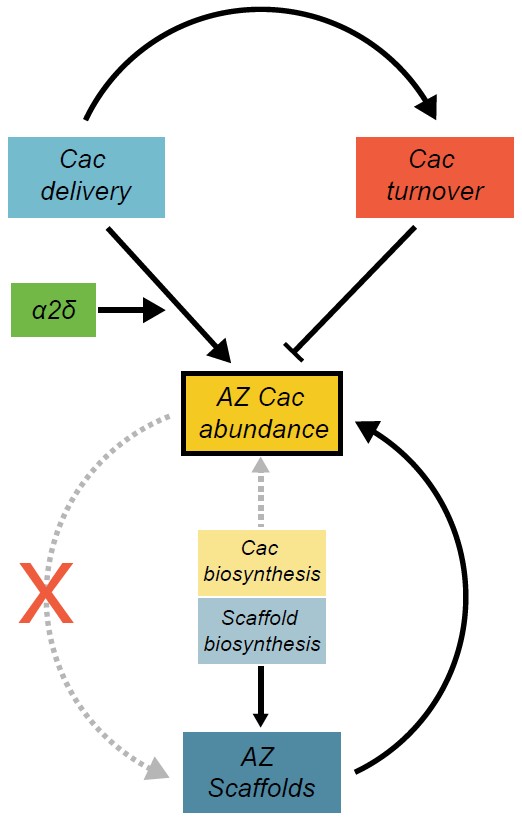
圖2 該團隊的模型顯示了調節活躍區域Cac豐度的因子。活躍區框架構建和通過alpha2delta實現Cac傳遞增加了Cac豐度,
且周轉率保持不變。而Cac的生物合成幾乎沒有增加豐度。
研究結果表明,除了Cac供應或BRP的變化之外,一定還有其他因素對Cac水平進行了如此嚴格的調節。Cunningham轉向alpha2delta。當她通過基因控制這些物質的表達量時,她發現alpha2delta的水平直接決定了活性區積累的Cac量。
在進一步的實驗中,Cunningham還能夠證明,alpha2delta維持Cac水平的能力取決于神經元的總體Cac供應。這一發現表明,alpha2delta可能在Cac運輸過程中發揮上游功能,向活躍區域供應和再供應Cac,而不是通過穩定Cac來控制活躍區域的Cac數量。
Cunningham使用了兩種不同的技術來觀察Cac補給的發生,測量了補給的程度和時間。在幼蟲發育幾天后她選擇了一個時間來拍攝活性區的圖像,并測量Cac豐度以確定全景。然后她通過漂白Cac熒光來消除它。24小時后重新觀察Cac熒光,只突出顯示在24小時內被送到活性區的新Cac。結果發現,當天幾乎所有活性區域都有Cac遞送,但一天的量與幾天前積累的量相比確實只是一個零頭。此外,她還發現較大的活性區比較小的活性區累積了更多的Cac。在alpha2delta突變的果蠅中,幾乎沒有新的Cac傳遞。
如果Cac通道確實能不斷被補充,Cunningham想知道Cac通道從活性區移除的速度如何。為了確定這一點,她使用了一種染色技術,將一種名為Maple的光轉換蛋白標記在Cac蛋白上,她可以在選定的時間用閃光改變顏色。通過這種方式,她可以首先看到在特定時間內積累了多少Cac(用綠色表示),然后閃光將Cac變成紅色。當她在5天后再次查看時,發現大約30%的紅色Cac已經被新的綠色Cac取代,這意味著30%的周轉。當她通過突變alpha2 delta或減少Cac生物合成來降低Cac傳遞水平時,Cac周轉停止。這意味著每天在活性區有大量的Cac周轉,周轉是由新的Cac交付推動的。
Littleton表示他們將在這些結果的基礎上進一步研究。現在,鈣離子通道豐度和補給的規則已經明確,他想知道當神經元經歷可塑性時——例如當新的傳入信息要求神經元調整它們的通信以擴大或減少突觸通信時——鈣離子通道會有何不同。他也渴望追蹤單個鈣離子通道如何在細胞體內產生然后沿著神經軸突向下移動到活躍區域,希望確定有其他哪些基因可能影響Cac豐度。
參考資料:
[1] New findings reveal how neurons build and maintain their capacity to communicate
 |
 |
 |
| 官網:www.baichuan365.com | 微信服務號:iseebio | 微博:seebiobiotech |
 |
 |
 |
| 商城:mall.seebio.cn | 微信訂閱號:seebiotech | 泉養堂:www.canmedo.com |
相關資訊
- Science子刊:揭示GCN2抑制腫瘤微環境中的抗腫瘤免疫反應
- GST標簽蛋白純化介質
- 生物技術服務-盡在西寶生物CRO專業服務平臺
- WAKO發光試劑--腔腸素/Coelenterazine
- Cell重磅解讀!科學家們成功在單細胞分辨率下解析機體腸道神經系統的奧秘!
- Cell:古老的酶AMCase保護哺乳動物免受肺部疾病
- DCP過氧引發劑
- CAR T療法新突破!Nat Med背靠背發表兩個研究團隊發現避免細胞因子風暴的新方法
- CFDA公安部發布通知嚴打違法銷售含可待因口服液
- 攜帶siRNA納米顆粒可抑制肺癌細胞
新進產品
同類文章排行
- 清除人體內衣原體感染的關鍵鑰匙
- iScience:一種對抗遺傳性神經系統疾病的潛在途徑
- 真的有可以中和所有已知COVID-19毒株的抗體?
- 細胞“廢物”使抗癌的免疫細胞恢復活力!
- 男性注意!這種食品攝入過多會導致結直腸癌
- 無路可退!主食中的農藥殘留,可誘發阿爾茨海默病
- Cell出乎意料新發現:原來是這種“瀕死體驗”讓癌細胞惡化
- 研究發現,冠狀病毒的形狀會影響其傳播
- Science Advances新突破:快速高效生產人體免疫細胞的新方法
- 《Nature Genetics》確定10個克羅恩病相關基因
資訊文章
您的瀏覽歷史