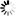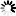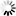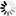Seebio®煙酰胺單核苷酸(nicotinamide mononucleotide,NMN)是一種自然存在的生物活性核苷酸,NMN有2種不規則存在形式,α和β;β異構體是NMN的活性形式,分子量為334.2g/mol。
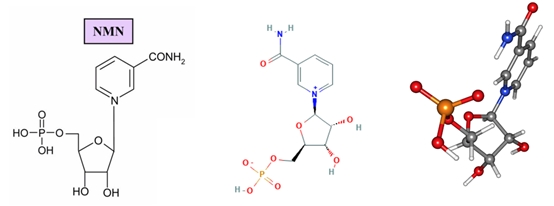
煙酰胺單核苷酸化學結構式和球棍模型
在細胞內,尼克酰胺單核苷酸(NMN)是煙酰胺腺嘌呤二核苷酸(NAD+)的重要前體。NAD+是一種在細胞內參與多種生物化學反應的輔酶,對于維持細胞正常功能和代謝至關重要。因此,NMN在細胞內具有重要的生物學意義。
|
產品名稱
|
CAS
|
純度
|
包裝
|
|
β-煙酰胺單核苷酸 (NMN)
|
1094-61-7
|
99%
|
1kg 5kg 10kg 25kg
|
詳詢西寶生物產品,請咨詢:400-021-8158 / 021-50272975。
NMN對NAD+的促進作用
主要體現在其作為NAD+的前體的功能上。在合成途徑中,煙酰胺核糖或煙酰胺通過NRK(煙酰胺核苷激酶)或NAMPT、NMNAT合成煙酰胺單核苷酸(NMN),隨后,NMN通過NMNAT1-3酶合成NAD+。
盡管不能在血清中檢測到完整結構的NMN,但攝入NMN仍能夠在很短的時間內(15分鐘)顯著提高雌性和雄性小鼠的NAD+水平。
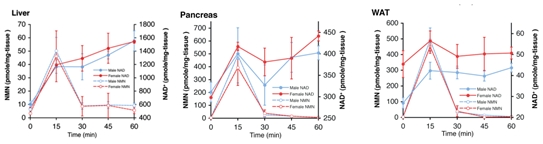
肝臟、胰腺、白色脂肪組織NMN、NAD+水平
NMN功效
NMN的主要作用是通過轉化為NAD+發揮其生物學功能。NAD+,全名煙酰胺腺嘌呤雙核苷酸,又被稱為輔酶I,廣泛分布在人體的所有細胞內,參與上千種生物催化反應,是人體內不可或缺的輔酶。
在衰老過程中,NAD+水平的下降被認為是導致各種疾病和殘疾的主要原因,包括抗衰老、認知和運動功能障礙、免疫缺陷,以及由自身免疫炎癥反應失調引起的關節炎、代謝障礙和心血管疾病。
通過補充NMN來提高體內NAD+含量,有助于延緩、改善和預防與衰老相關的多種表型,包括年齡誘導的代謝紊亂和老年疾病。
NAD+與衰老
人體持續進行能量合成與代謝,以保持生命活動的平衡與健康。在這一過程中,煙酰胺腺嘌呤二核苷酸(NAD+)作為氧化還原反應的輔酶,扮演著關鍵角色。NAD+直接或間接地調控多個細胞功能,包括線粒體內的能量合成、DNA損傷修復、染色質重塑,以及細胞衰老和免疫細胞功能。這些細胞的基本生理過程和功能對于維持組織、代謝動態平衡及健康衰老至關重要。
衰老是人體的自然過程。隨著年齡增長,人體內NAD+水平逐漸減少,導致多個器官內的線粒體能量合成下降,包括大腦、脂肪組織、皮膚、肝臟、骨骼肌和胰腺。與NAD+水平的降低相關聯的是一系列與年齡有關的疾病,如認知功能減退、癌癥、代謝性疾病、肌少癥和衰弱。因此,通過調節NAD+代謝通路,增加NAD+水平可能成為改善衰老相關疾病、延長人類壽命和健康壽命的潛在途徑。
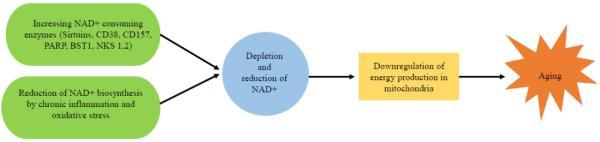
衰老過程中體內NAD+減少的原因
NMN與抗衰老
作為NAD+的前體物質,NMN理論上通過增加體內NAD+水平,減緩隨年齡增長而導致的NAD+枯竭過程,從而成為一種抗衰老保健品。
科學界通過細胞試驗、動物模型和臨床試驗對NMN的抗衰老活性進行了廣泛研究。研究發現,NMN在嚙齒動物模型和人體水平上均表現出有益效果,如保護內皮細胞、改善血供、改善代謝功能障礙以及保護神經系統。一項2021年的隨機雙盲臨床試驗顯示,NMN治療對絕經后超重或肥胖的糖尿病前期女性產生了積極效果,增強了肌肉對胰島素的敏感性。類似的研究在2023年也表明,NMN治療能夠顯著提高血清煙酰胺水平,減緩動脈僵硬度。此外,NMN的長期使用和潛在的副作用需要更多深入的研究和驗證。
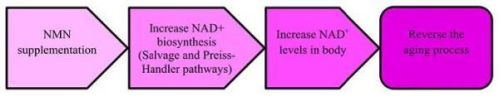
NMN抗衰老的機制
NAD+與神經系統
Sirtuins是依賴NAD+的脫酰基酶,傳統上與熱量限制和衰老有關。在神經發育中,SIRT1通過Akt-GSK3通路促進軸索生長、神經突生長和樹枝狀分支。在突觸的發育和調節中,sirtuins蛋白在生理和損傷后都發揮著重要的調節作用。特別是在海馬體中,SIRT1以抑制型復合體形式存在,參與調控microRNA-134的轉錄因子YY1,這對于突觸的形成和長期的增強至關重要。
在神經疾病的發展中,SIRT1發揮著保護作用,尤其在阿爾茨海默氏病、帕金森氏病和運動神經元病等神經退行性疾病中。這些保護作用可能與SIRT1在代謝、抗應激和基因組穩定性方面的功能有關。因此,激活SIRT1的藥物可能為治療這些神經疾病提供一種有希望的方法。
NAD+與癌癥
研究表明增加NAD+水平可能對癌癥治療具有潛在效果。NMNAT3的過表達可以提高線粒體NAD+水平,從而抑制膠質母細胞瘤細胞的生長。補充煙酰胺(NA)或煙酰胺單核苷酸(NAM)可以抑制SCID小鼠的腫瘤生長和多器官腫瘤轉移。其原理包括過量的NAD+促進線粒體呼吸,降低糖酵解,抵消癌細胞傾向的Warburg代謝。增加NAD+還能活化SIRT1和SIRT6,兩者通過下調β-catenin信號和抑制糖酵解來抑制腫瘤。然而存在一些矛盾和擔憂,如NAD+促進DNA修復和血管生成,可能有助于癌細胞的生長。此外,降低腫瘤NAD+水平可能增加癌細胞對化療藥物的敏感性。因此,在標準癌癥模型中進一步測試NAD+補充劑的效果是非常重要的。
NAD+與晝夜節律
NAD+是一種關鍵的生物分子,其依賴的脫乙酰酶SIRT1通過連接調節NAD+補救途徑的酶反饋回路和晝夜節律轉錄-翻譯反饋回路,成為晝夜節律與代謝之間的橋梁。NAD+通過SIRT1實現對生物鐘的調節,其中SIRT1將BMAL1和PER2去乙酰化,抑制CLOCK-BMAL1介導的clock genes的轉錄。此外,NAD+通過影響SIRT1的去乙酰化活性,反過來影響包括NAMPT在內的一系列生物鐘相關蛋白的表達。
生物鐘調節與多種疾病相關,包括但不限于睡眠障礙、糖尿病和腫瘤。紊亂的生物鐘可能是多種病理過程的觸發因素,可能源自遺傳或環境因素。總體而言,維持正常的生物鐘功能對于保持健康至關重要。
NAD+與肝功能
NAD+信號通路中的酶已被證明可以保護肝臟免受脂肪堆積、纖維化和胰島素抵抗的影響,這些因素與脂肪肝病發生有關。NAMPT在高脂飲食誘導的脂肪肝發生中發揮關鍵調節作用,其抑制將使肝脂肪變性更加嚴重,而NAMPT的過表達則改善肝脂質積累。SIRT1及其下游靶點(PGC-1a、PSK9和SREBP1)維持線粒體功能、膽固醇轉運和脂肪酸穩態。SIRT2通過去乙酰化磷酸烯醇丙酮酸羧激酶來控制糖異生,SIRT3調控OXPHOS、脂肪酸氧化、酮生成和抗氧化應激,而SIRT6控制糖異生。由于這些通路在肝臟中的重要性,維持NAD+水平對于維持器官功能至關重要。在正常情況下,由于肥胖和衰老,NAMPT水平下降,CD38水平升高,導致到中年時,穩態NAD+水平下降2倍。將NAD+水平提高到年輕水平在預防和治療肥胖、酒精性脂肪性肝炎和NASH方面表現出顯著效果,同時還改善葡萄糖穩態和線粒體功能,增強肝臟再生能力,保護肝臟免受肝毒性損害。
NAD+與腎功能
老年腎臟中NAD+水平的降低和sirtuin活性的下降在很大程度上是腎功能和順應性隨年齡下降的原因。通過NAD+補充可以激活SIRT1和SIRT3,從而保護高糖誘導的腎系膜細胞肥大。同時,使用NMN治療小鼠以SIRT1依賴的方式保護順鉑誘導的急性腎損傷(AKI)。5-氨基咪唑-4-羧胺核苷可刺激AMPK活性,增加NAD+水平,并以SIRT3依賴的方式保護順鉑誘導的AKI。小鼠補充NAM可以刺激腎臟保護前列腺素PGE2的分泌,提升缺血后腎功能;同時,NAM也通過刺激NAD+合成抑制順鉑誘導的AKI。
NAD+與骨骼肌
與年輕的野生型小鼠相比,老年小鼠的肌肉表現出萎縮、炎癥標志物增加以及胰島素信號和胰島素刺激葡萄糖攝取能力下降。有關骨骼肌的研究表明:用NAD+前體治療老年小鼠可以顯著改善肌肉功能。使用NMN進行治療可以通過增加線粒體功能、提高ATP生成、減少炎癥,并將糖酵解II型肌肉轉變為氧化纖維型肌肉,逆轉與年齡相關的有害變化。這表明NAD+的補充可能有助于保持肌肉健康和功能,特別是在老年階段。
NAD+與心臟功能
NAD+水平對正常心臟功能和損傷后的恢復至關重要。有關心臟功能的研究表明:SIRT3在心臟功能中是至關重要的,SIRT3敲除小鼠表現為OXPHOS酶的高度乙酰化,導致ATP減少,使主動脈對收縮高度敏感,可能與線粒體通透性過渡孔的調節因子CypD的激活有關。SIRT3-KO鼠在13個月大時出現纖維化和心肌肥厚,隨著年齡增長,病情進一步加劇,而NMN治療可以逆轉這種下降。使用NAMPT過表達或NMN治療能顯著防止壓力過載和缺血-再灌注損傷,減少梗死面積。NAD+前體治療改善了老年MDX心肌病小鼠的心臟功能。NAD+前體提高了缺鐵誘導的心力衰竭小鼠模型的線粒體和心臟功能。NAD+前體通過激活SIRT3保護并恢復弗里德希氏共濟失調(FRDA)心肌病小鼠模型的心臟功能。
NAD+與血管內皮細胞
內皮細胞(EC)的衰老與血管疾病密切相關,而NAD+前體NMN的補充在一些研究中顯示了改善效果:NMN治療老年小鼠可恢復頸動脈內皮依賴性擴張,降低主動脈脈搏波速和彈性動脈剛度。NMN對老年小鼠的治療取得顯著療效,通過促進SIRT1-依賴的毛細血管密度的增加,改善了老年小鼠的血液流動和耐力。NMN通過改善老年小鼠的血管內皮功能和神經血管耦合反應,顯著提高老年小鼠的認知。同時,NMN還降低了老齡鼠腦微血管內皮細胞的線粒體ROS,恢復了NAD+和線粒體能量。在血管內皮中增加NAD+水平可能成為一種提高老年人活動能力的潛在療法,并能治療因血流減少而導致的疾病,如缺血-再灌注損傷、傷口愈合緩慢、肝功能障礙和肌肉肌病等。
NAD+與代謝障礙
NMN對脂肪代謝和糖代謝紊亂導致的肥胖、Ⅱ型糖尿病、生殖抑制都具有改善作用。甚至能夠改善肥胖母親對雌性后代生殖的不良影響。 NAD+前體的補充可能在代謝障礙的治療中發揮重要作用。
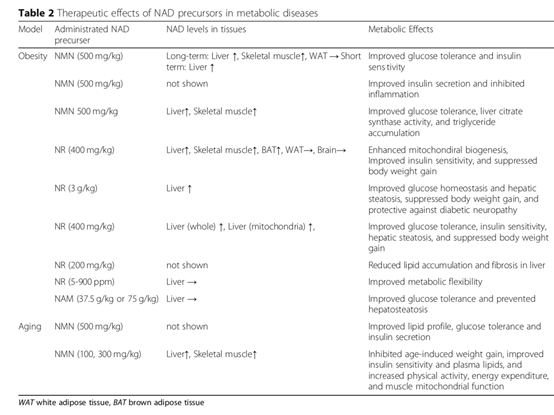
NAD+前體在動物實驗中對代謝障礙的治療作用
參考文獻:
[1].Nadeeshani, H., et al., Nicotinamide mononucleotide (NMN) as an anti-aging health product - Promises and safety concerns. J Adv Res, 2022. 37: 267-278.
[2]. Liu, L., Su, X., Quinn, W. J., 3rd, Hui, S., Krukenberg, K., Frederick, D. W., . . . Rabinowitz, J. D. (2018). Quantitative Analysis of NAD Synthesis-Breakdown Fluxes. Cell Metab, 27(5), 1067-1080 e1065. doi:10.1016/j.cmet.2018.03.018
[3]. Bonkowski, M. S., & Sinclair, D. A. (2016). Slowing ageing by design: the rise of NAD(+) and sirtuin-activating compounds. Nat Rev Mol Cell Biol, 17(11), 679-690. doi:10.1038/nrm.2016.93
[4]. Clement, J., Wong, M., Poljak, A., Sachdev, P., & Braidy, N. (2019). The Plasma NAD(+) Metabolome Is Dysregulated in "Normal" Aging. Rejuvenation Res, 22(2), 121-130. doi:10.1089/rej.2018.2077
[5]. Yang, Y., & Sauve, A. A. (2016). NAD(+) metabolism: Bioenergetics, signaling and manipulation for therapy. Biochim Biophys Acta, 1864(12), 1787-1800. doi:10.1016/j.bbapap.2016.06.014
[6].H. Kim, E.L. Jacobson, M.K. Jacobson, Science 261 (1993) 1330–1333.
[7]. Pehar, M., Harlan, B. A., Killoy, K. M., & Vargas, M. R. (2018). Nicotinamide Adenine Dinucleotide Metabolism and Neurodegeneration. Antioxid Redox Signal, 28(18), 1652-1668. doi:10.1089/ars.2017.7145
[8].M.B. Schultz, D.A. Sinclair, Cell Metab. 23 (2016) 965–966.
[9]. Davila, A., Liu, L., Chellappa, K., Redpath, P., Nakamaru-Ogiso, E., Paolella, L. M., . . . Baur, J. A. (2018). Nicotinamide adenine dinucleotide is transported into mammalian mitochondria. Elife, 7. doi:10.7554/eLife.33246
[10].M. Howard, J.C. Grimaldi, J.F. Bazan, F.E. Lund, L. Santos-Argumedo, R.M. Parkhouse, T.F. Walseth, H.C. Lee, Science 262 (1993) 1056–1059.[6
[11].J. Camacho-Pereira, M.G. Tarragó, C.C.S. Chini, V. Nin, C. Escande, G.M. Warner, A.S. Puranik, R.A. Schoon, J.M. Reid, A. Galina, E.N. Chini, Cell Metabolism 23 (2016) 1127–1139.
[12]. Chini, C. C. S., Tarrago, M. G., & Chini, E. N. (2017). NAD and the aging process: Role in life, death and everything in between. Mol Cell Endocrinol, 455, 62-74. doi:10.1016/j.mce.2016.11.003
[13]. Grozio, A., Mills, K. F., Yoshino, J., Bruzzone, S., Sociali, G., Tokizane, K., . . . Imai, S. I. (2019). Slc12a8 is a nicotinamide mononucleotide transporter. Nat Metab, 1(1), 47-57. doi:10.1038/s42255-018-0009-4
[14]. Araki, T., Sasaki, Y., & Milbrandt, J. (2004). Increased nuclear NAD biosynthesis and SIRT1 activation prevent axonal degeneration. Science, 305(5686), 1010-1013. doi:10.1126/science.1098014
[15]. Ratajczak, J., Joffraud, M., Trammell, S. A., Ras, R., Canela, N., Boutant, M., . . . Canto, C. (2016). NRK1 controls nicotinamide mononucleotide and nicotinamide riboside metabolism in mammalian cells. Nat Commun, 7, 13103. doi:10.1038/ncomms13103
[16]. Pehar, M., Harlan, B. A., Killoy, K. M., & Vargas, M. R. (2018). Nicotinamide Adenine Dinucleotide Metabolism and Neurodegeneration. Antioxid Redox Signal, 28(18), 1652-1668. doi:10.1089/ars.2017.7145
[17].J. Clement, M. Wong, A. Poljak, P. Sachdev, N. Braidy, Rejuvenation Res. (2018).